2022年7月2日,北京生命科学研究所/清华大学生物医学交叉研究院黄牛实验室与北京化工大学郑国均课题组合作,在期刊 Bioorganic & Medicinal Chemistry Letters 发表了文章 Design, synthesis, and bioactivity evaluation of macrocyclic benzo[b]pyrido[4,3-e][1,4]oxazine derivatives as novel Pim-1 kinase inhibitors, 发现一类新型的大环类 Pim-1 激酶抑制剂,并结合分子动力学模拟和晶体学手段对结合模式进行了探究。
Pim-1 激酶是一种丝氨酸/苏氨酸激酶,在许多肿瘤中起重要作用。前期工作中,黄牛团队联合郑国均团队发现了 Pim-1 抑制剂 10-DEBC 及其衍生物,具有较高的抑制活性。希望在此基础上,进一步开发骨架新颖、物理化学性质(如膜通透性)更优的抑制剂。
大环化合物是具有十二个或更多原子的大环的分子,在小分子药物的研究中引起了很多关注。大环化对PK/PD、效力和靶标选择性有显著影响,提供了改善化合物效力、选择性、膜通透性和其他相关物理化学性质的机会。根据大环化的设计思路,参考 Pim-1 激酶与 10-DEBC 及其衍生化合物 26 的复合物晶体结构,确定了分子内环化的位点。用于环化的连接片段可用于探索靶点铰链区和相邻残基周围形成的疏水空间。通过采用不同长度和类型的连接片段,设计了多种 benzo[b]pyridine[4,3–e][1,4]oxazine 大环化合物。合成工作由郑国均团队完成。
为了探究大环化合物的结合模式,使用 GROMACS 程序进行了分子动力学模拟。大环分子难以进行充分合理的构象采样,考虑到 RDKit 中实现的 ETKDG 方法能够妥善处理大环分子的二面角扭转势能,模拟前使用该算法对大环分子的三维结构进行了建模。化合物 H3 的分子动力学模拟结果显示,其在 Pim-1 结合口袋中保持稳定的结合构象,表明与结合位点残基形成了良好的相互作用。
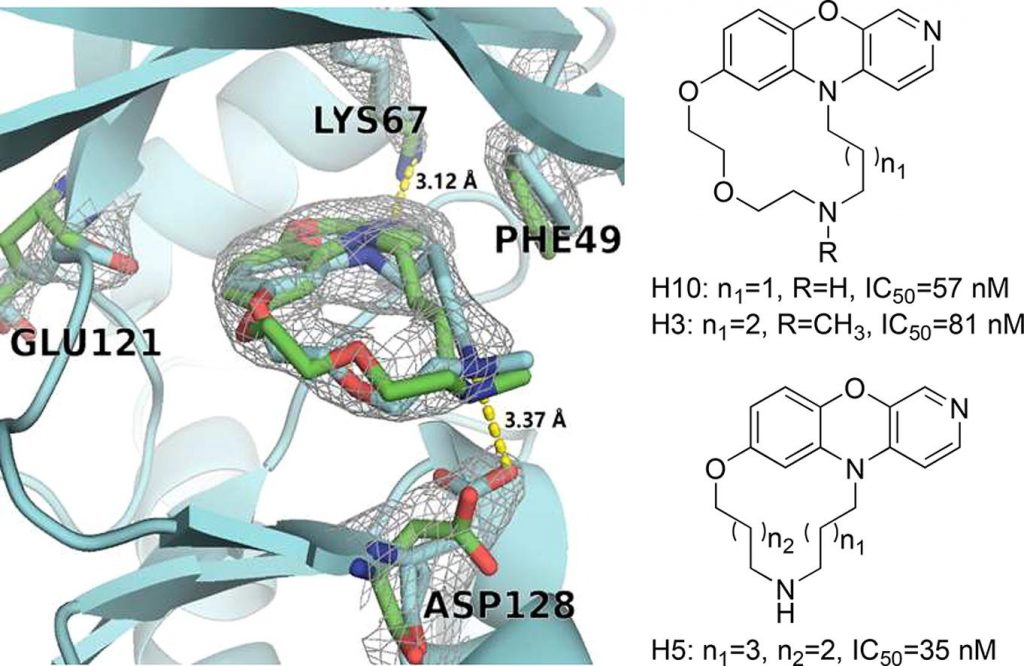
激酶活性试验结果表明,大环化合物 H3、H5 和 H10 具有较高的抑制活性(IC50 < 100 nM),其中化合物 H5 的 IC50 达到了 35 nM。解析获得的 Pim-1 激酶与化合物 H3 的复合物晶体结构显示,化合物 H3 的晶体学结合模式与分子动力学模拟的结果基本一致。具体而言,化合物 H3 脂肪链中的胺基与 Asp128 形成盐桥相互作用,吡啶环中的氮原子与 Lys67 形成氢键相互作用,吡啶环和 Phe49 形成的面对边 π-π 相互作用 (edge-to-face π-π interaction)也被观察到。
该工作总结了一类新型大环化合物的结构活性关系,为进一步优化 Pim-1 激酶的新型大环抑制剂提供了坚实的基础。